Covid, Ema: “Dose booster sicura e efficace già a 3 mesi dalla seconda”
"Su variante Omicron troppo presto per dire se serviranno adattamenti dai vaccini attuali contro il Covid"
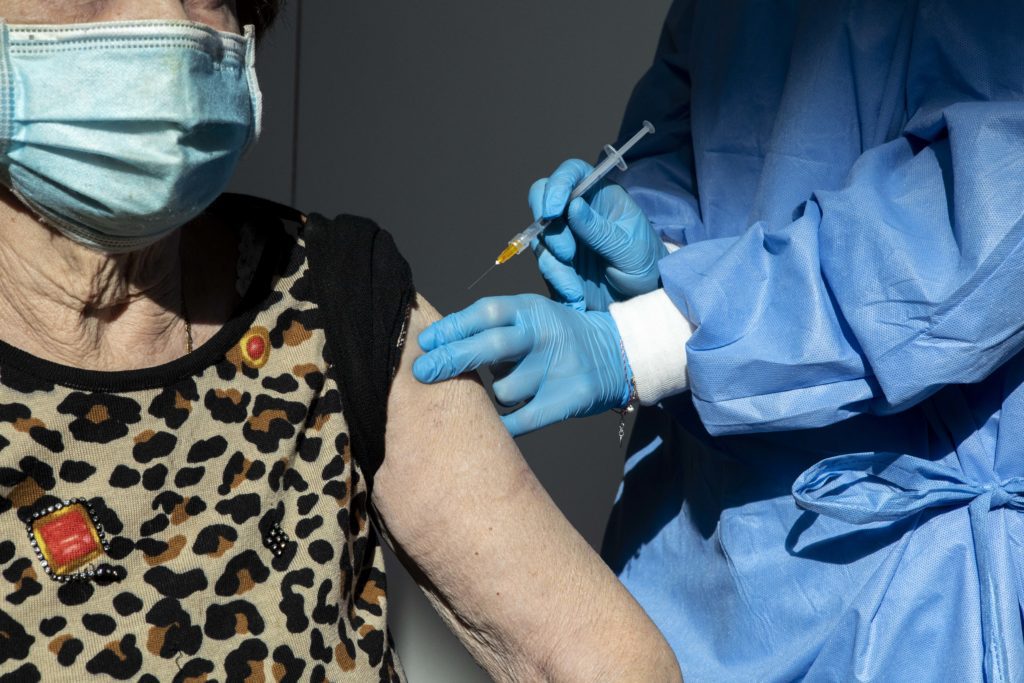
ROMA – “La raccomandazione attuale è di somministrare la dose booster del vaccino anti Covid-19 preferibilmente dopo 6 mesi. I dati disponibili supportano la somministrazione sicura ed efficace di una dose di richiamo già a 3 mesi dal completamento della vaccinazione primaria“, ha spiegato il responsabile della task force vaccini anti-Covid dell’Agenzia europea per i medicinali (Ema), Marco Cavaleri, nel corso del consueto briefing con la stampa.
IL VACCINO PER I BAMBINI TRA 5 E 11 ANNI
“I dati epidemiologici mostrano che negli ultimi mesi le infezioni e i ricoveri di bambini di età compresa tra i 5 e gli 11 anni sono in aumento. Mentre i piccoli a rischio di contrarre in modo grave il Covid-19 dovrebbero avere la priorità, tutti i bimbi in questa fascia di età dovrebbero essere presi in considerazione per la vaccinazione”, ha proseguito Cavaleri. “I dati sulla sicurezza nella somministrazione del vaccino anti Covid-19 di Pfizer-BioNTech per i bambini di età compresa tra i 5 e gli 11 anni sono rassicuranti- ha proseguito
Cavaleri- finora non sono emersi problemi di sicurezza dalle grandi campagne di vaccinazione in questa fascia di età negli Stati Uniti”.
SULLA VARIANTE OMICRON
“In questa fase non disponiamo di dati sufficienti sull’impatto della variante Omicron sull’efficacia dei vaccini Covid-19 approvati, ma stiamo continuamente monitorando e raccogliendo prove- ha dichiarato il responsabile della task force vaccini anti-Covid dell’Agenzia europea per i medicinali (Ema)- è troppo presto per dire se serviranno adattamenti dai vaccini attuali contro il Covid alla variante Omicron”.
EMA VERSO OK AD ANTICORPO MONOCLONALE XEVUDY
“Xevudy, un anticorpo monoclonale antivirale, sarà preso in considerazione dal nostro comitato per i medicinali per uso umano la prossima settimana per il trattamento contro il Covid-19″, ha spiegato Cavaleri, precisando che la terapia, sviluppata da Gsk e Vir Biotechnology e che la scorsa settimana ha ricevuto il via libera da parte del Regno Unito, è destinata ai “pazienti che non richiedono ossigeno aggiuntivo e che sono a maggior rischio di progressione della malattia”.
SU NOVAVAX POSSIBILE VALUTAZIONE ENTRO FINE ANNO
“Prima della fine dell’anno potremmo concludere la valutazione del vaccino Novavax contro il Covid-19”, ha reso noto il responsabile della task force vaccini anti-Covid dell’Agenzia europea per i medicinali. Autorizzato per l’uso di emergenza solamente in Indonesia, il vaccino Novavax si basa su una diversa tecnologia rispetto a quelli autorizzati fino ad oggi nell’Unione europea. Prevede la somministrazione di due dosi e può essere conservato in frigorifero.
Le notizie del sito Dire sono utilizzabili e riproducibili, a condizione di citare espressamente la fonte Agenzia DIRE e l’indirizzo www.dire.it